
QUÉ ES LA ACONDROPLASIA
- Inicio
- MEDICINA Y CIENCIA
- QUÉ ES LA ACONDROPLASIA
QUÉ ES LA ACONDROPLASIA: FUNDAMENTOS

RESUMEN DE CONOCIMIENTO CIENTÍFICO SOBRE LA ACONDROPLASIA
I. INTRODUCCIÓN
En la revisión de 2015 del listado de alteraciones óseas debidas a modificaciones genéticas se han reconocido 436 diferentes displasias óseas (Bonafé L et al., 2015) y la cifra sigue creciendo. La acondroplasia es la más frecuente de estas displasias óseas. Está causada por una alteración genética que afecta a la placa de crecimiento óseo principalmente (Bouali H y Latrech H, 2015).
La acondroplasia se considera una enfermedad de muy baja frecuencia (del inglés rare). Las enfermedades raras son las que afectan a menos de 1 de cada 2000 personas de la población general. Hay más de 7000 enfermedades raras identificadas hasta la fecha y se cree que afectan a 30 millones de ciudadanos de la Unión Europea. En general, el ochenta por ciento de todas las enfermedades raras tiene un origen genético. A menudo son crónicas y conllevan riesgo de muerte (EURORDIS, 2016).
La modificación genética (mutación) que produce la acondroplasia aparece en alguna de las células progenitoras de forma espontánea en el 80% de los casos (de padres sin mutación). Es una mutación autosómica dominante con penetrancia esencialmente completa que heredan todas las células del embrión (Bouali H y Latrech H, 2015) (ver la siguiente sección para más información). La acondroplasia tiene lugar con una frecuencia similar en ambos sexos y en todos los grupos étnicos (Horton W et al., 2007) y afecta a aproximadamente a 250.000 personas en todo el mundo (Narayana J y Horton W, 2013). La prevalencia mundial es de aproximadamente 1 de cada 25.000 nacimientos vivos (Orphanet, 2017).
El término achondroplasia fue utilizado por primera vez por Jules Parrot en 1878 y en 1900 Pierre Marie describió las principales características clínicas en niños y adultos (Baujat G et al., 2008). Aunque la modificación genética causante de la acondroplasia se identificó en 1994, se ha encontrado evidencia arqueológica de la existencia de individuos con acondroplasia en el antiguo Egipto (2500 a.C.) y en las antiguas poblaciones americanas (300 a.C.) (Rodríguez C et al., 2012). El descubrimiento de esqueletos de individuos aparentemente condrodistróficos entre 7000 y 3000 a.C. en Inglaterra y en los Estados Unidos, revela que esta anomalía genética se remonta al menos al período neolítico (Ortega A y Hernández J, 2008).
La manifestación principal de la acondroplasia es una alteración de la formación del tejido óseo (osteogénesis u osificación) durante el desarrollo. Existen dos mecanismos de osificación, uno de ellos es la osificación desmal en la que se genera hueso directamente a partir de un tejido embrionario o mesénquima y es la que ocurre durante la formación de los huesos de la base y la cubierta del cráneo. Otro mecanismo es la osificación endocondral en la que se genera hueso por sustitución de un tejido más flexible y maleable que es el cartílago. Este mecanismo es el que se produce durante la formación de los huesos de la cara y los huesos largos (extremidades superiores e inferiores).
Las células que originan el cartílago se llaman condrocitos. Durante la osificación endocondral, se forma nuevo cartílago en los extremos de los huesos largos (placa de crecimiento epifisaria) y este cartílago se transforma en hueso gracias a la diferenciación de los condrocitos, que se transforman en células óseas llamadas osteoblastos y osteoclastos. Los condrocitos, localizados en la placa de crecimiento, son las células clave en el crecimiento del hueso largo. Se diferencian a través de fases proliferativas, pre-hipertróficas e hipertróficas a medida que el hueso crece (Figura 1, Alman B, 2015). Así, los condrocitos deben proliferar (dividirse en dos células y éstas en otras dos células y así sucesivamente) para generar más condrocitos algunos de los cuales dejarán de dividirse y se diferenciarán en células óseas durante el desarrollo del individuo.
En los condrocitos, la mutación que causa la acondroplasia hace que dejen de dividirse y se diferencien en células óseas por lo que se distorsiona el ritmo de producción de hueso durante el desarrollo dando lugar a la displasia ósea.
La alteración en el crecimiento longitudinal de los huesos de las extremidades inferiores (el fémur, la tibia y el peroné) impide la ganancia de altura respecto al crecimiento del tronco y provoca desproporción tronco-extremidades. La alteración en el crecimiento longitudinal de los huesos de las extremidades superiores (húmero, cúbito y radio) provoca desproporción tronco-extremidades. La alteración en el crecimiento de los huesos de la cara provoca rasgos faciales característicos de la acondroplasia.
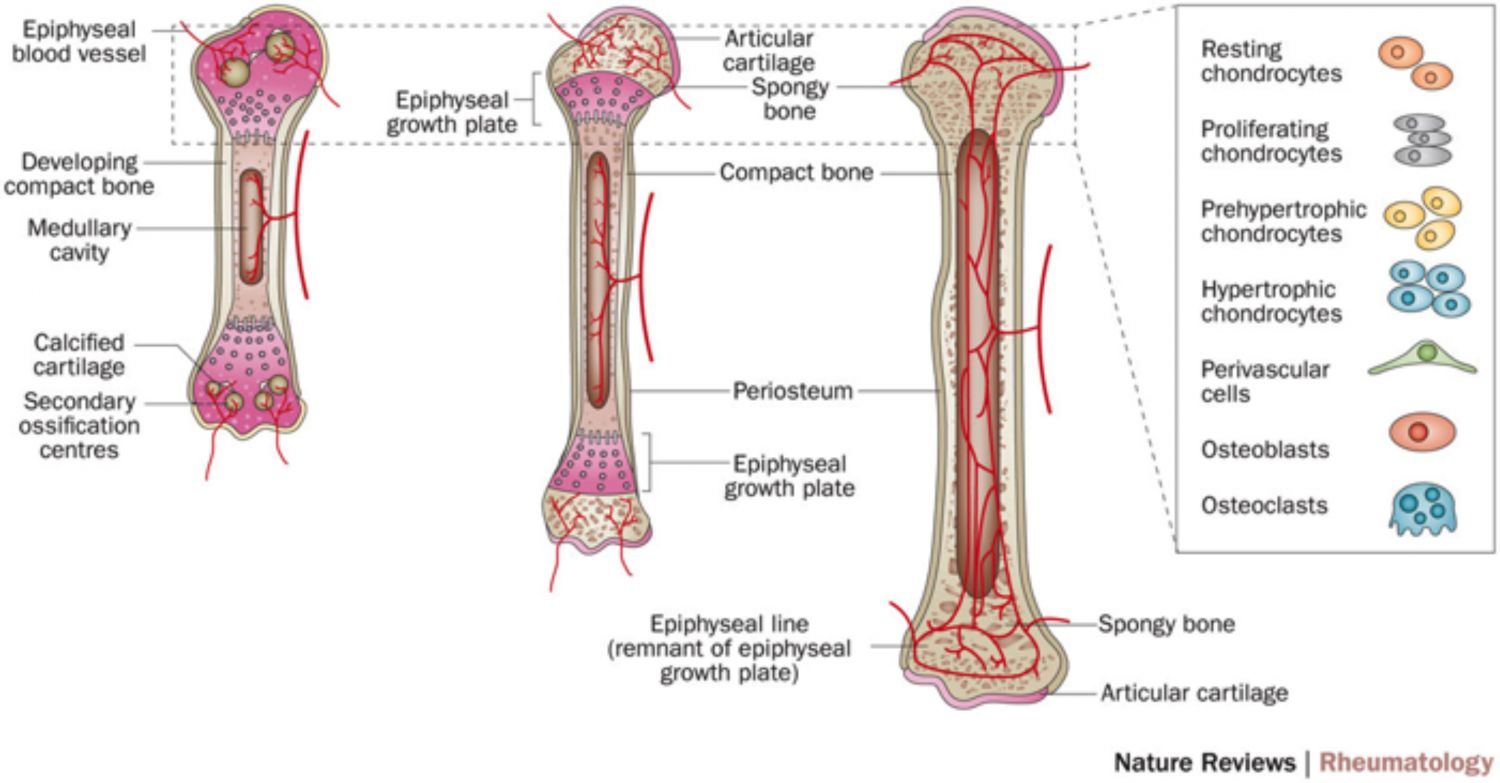
Imagen 1. Diferenciación de los condrocitos en la placa de crecimiento, que produce el crecimiento longitudinal del hueso (Alman B, 2015).
II. CARACTERÍSTICAS CLÍNICAS DE LA ACONDROPLASIA
Las características clínicas y radiológicas de la acondroplasia son fácilmente identificables: talla baja desproporcionada con acortamiento rizomélico (parte superior) de brazos y piernas, cifosis toracolumbar (a temprana edad, antes de caminar) e hiperlordosis lumbosacra (al caminar) (Bouali H y Latrech H, 2015), cabeza grande (macrocefalia), frente prominente, puente nasal hundido, hipoplasia maxilar, disfunción del sistema respiratorio superior y estenosis del foramen magno (Shirley ED y Ain MC, 2009). Las manos y los dedos son cortos en forma de tridente desde muy pronto y presentan imposibilidad de unir totalmente los dígitos tercero y cuarto (Baujat G et al., 2008; Harris H, 2012).
Otros tejidos afectados son los músculos (hipotonía muscular) y los ligamentos (laxitud ligamentosa) (Unger S, Gouze L, 2017). Se desconoce si esto es debido a la mutación en las células musculares y ligamentosas o es consecuencia de la displasia ósea o una mezcla de ambas.
A) INFANCIA: del nacimiento a los dos años
Hay una mayor mortalidad neonatal por hidrocefalia y anomalía en la caja torácica de los neonatos.
Las manifestaciones displásicas principales de los niños con acondroplasia durante los 2 primeros años de vida son las siguientes:
Huesos del cráneo
Presentan cabeza grande (macrocefalia) y abombamiento frontal. La macrocefalia puede ser consecuencia de una presentar ventrículos cerebrales grandes (ventriculomegalia)y presencia de líquido en el cráneo (hidrocefalia externa benigna) (del Pino M et al., 2011; Zahl S et al., 2011). Hay un pequeño riesgo de hidrocefalia ventricular debida al aumento de la presión venosa intracraneal.
La zona media de la cara y sus estructuras internas se encuentran subdesarrolladas. Las vías respiratorias altas son estrechas, lo que puede causar apnea obstructiva del sueño, que pueden empeorar unas amígdalas y adenoides hipertrofiados. La caja torácica puede ser estrecha y oprimida, lo que reduce la capacidad pulmonar y también puede dar lugar a problemas respiratorios (Ottonello G et al., 2007)
Durante la primera infancia puede darse una compresión de la médula espinal a la altura del foramen magno (apertura en la base del cráneo, en el hueso occipital) que cause apnea central, retraso en el desarrollo y síntomas neurológicos como clonus, espasticidad muscular o disfunción de la vejiga neurogénica (incapacidad del esfínter urinario para aumentar o disminuir adecuadamente su presión en respuesta al aumento de la presión de la vejiga que usualmente indica una lesión en la parte media o superior de la médula espinal o en el cerebro) (Ireland P et al., 2014; Dorsher P y McIntosh P, 2012). La compresión de la médula espinal también se ha relacionado con casos de muerte súbita durante el primer año de vida. Estudios poblacionales apuntan a que este aumento del riesgo de muerte puede alcanzar hasta un 7,5% (Pauli R, 2012).
Espina dorsal
Los niños con acondroplasia suelen desarrollar durante los primeros meses de vida una cifosis toracolumbar (Misra S y Morgan W, 2003), un abultamiento de la columna vertebral consecuencia de la hipotonía muscular general y la macrocefalia (Ireland P et al., 2014). Sin embargo, en la mayoría de los niños esta deformidad se corregirá espontáneamente a medida que los músculos espinales se fortalezcan y aumente su fuerza.
Huesos largos
Al nacer los niños con acondroplasia tienen a menudo una talla normal (las tallas principales al nacimiento son 47.7 cm and 47.2 cm para varones y hembras, respectivamente).
Debido al acortamiento proximal de las extremidades, los niños con acondroplasia suelen tener abundantes pliegues cutáneos (Baujat G et al., 2008).
Otros tejidos
Presentan hipotonía muscular y laxitud ligamentosa.
B) INFANCIA: de 3 a 12 años
Las manifestaciones displásicas principales de los niños con acondroplasia durante los 3 a 12 años de vida son las siguientes:
Huesos del cráneo
Los rasgos craneofaciales de los niños con acondroplasia son: estenosis de las vías respiratorias superiores; retraimiento de la barbilla (micrognatia); aumento de la parte inferior de la cara debido a un mayor ángulo mandibular que, a su vez, se debe a la osificación parcial de los huesos craneales (Zaffanello M et al., 2017). Estos rasgos también pueden conllevar mala oclusión dental y presión de la lengua. La hipoplasia de la parte media de la cara en combinación con la hipertrofia de las amígdalas y los adenoides puede provocar apnea obstructiva del sueño (Krakow D y Rimoin D, 2010). Es típico el hacinamiento dental debido al menor tamaño del maxilar y el hueso mandibular (Al-Saleem A y Al-Jobair A, 2010).
Es frecuente que sufran de otitis media recurrente, a menudo asociada con pérdida auditiva e hipertrofia de las amígdalas y adenoides (Wrigth M y Irving M, 2011).
Espina dorsal
Como ya se ha visto, hay un retraso a menudo en los hitos del desarrollo motor y de la adquisición del lenguaje. Cuando los niños empiezan a caminar, la cifosis toracolumbar generalmente se convierte en lordosis lumbar (Wright M y Irving M, 2011). La mayoría de los lactantes presentan hipotonía muscular generalizada, en general moderada, que parece ser la causa del retraso en el desarrollo de las habilidades motoras. Cuando no se trata, esta debilidad muscular, junto con la cabeza y el peso sobredimensionados, tienden a originar una hiperflexión de la columna vertebral que favorece el acuñamiento de la primera y segunda vértebras lumbares (ALPE, 2008). Cuando no se trata, puede desarrollarse una cifosis toracolumbar permanente o progresiva. También pueden presentarse una inclinación tibial y una estenosis espinal lumbar sintomática (Wright M y Irving M, 2011).
Huesos largos
Longitud reducida y con una progresión específica recogida en las tablas de crecimiento para población con acondroplasia.
Los niños con acondroplasia pueden presentar hiperlaxitud articulatoria y curvatura tibial (genu varum) (Krakow D y Rimoin D, 2010). Aproximadamente el 10% de los niños presentan una marcada curvatura tibial a la edad de cinco años y más del 40% de los adultos podrían presentar curvatura de tibias. El arqueamiento tibial se ha asociado con dolor recurrente en las piernas y molestias (Hunter AG el at., 1998).
Es habitual una limitación de la extensión de codo debido a una deformación convexa posterior del húmero distal. En los pacientes con dislocación asociada de la cabeza radial la pérdida de extensión es más grave (Haga N, 2004). Esto conlleva una limitación de funcionalidad que afecta actividades básicas diarias como la higiene personal.
Caderas
Tanto los niños como los adultos con acondroplasia presentan de forma uniforme contracturas de flexión de la cadera a las que se ha achacado la conocida lordosis lumbosacra y que pueden ser causa importante de dolor de espalda y fatiga muscular de la que informan los afectados de acondroplasia. Es típica la hiperlaxitud en las rodillas y los dedos de los niños con acondroplasia (Ireland P et al., 2014).
Otros tejidos
La obesidad también es un problema frecuente como consecuencia de que los niños con acondroplasia por lo general tienen actividades físicas más restringidas o patrones de alimentación no adecuados y pueden presentar un aumento del índice de masa corporal (IMC) o una mezcla de ambas. Por otra parte, en niños de estatura media, se observan distintos patrones de IMC durante el crecimiento y es posible predecir indicadores de la pubertad y el riesgo de obesidad adulta, pero la relevancia de estos patrones para la población de acondroplasia es desconocida (Hoover-Fong J et al., 2008). Se puede encontrar más información, así como las curvas de IMC para la acondroplasia, en la sección "Manejo clínico".
Otros síntomas
Presentan sudoración aumentada.
C: ADOLESCENCIA Y EDAD ADULTA
Las manifestaciones displásicas principales en edad adulta con acondroplasia son las siguientes:
Huesos del cráneo
No se describen displasias específicas de los huesos del cráneo que aparezcan en la adolescencia ni en la edad adulta. Las manifestaciones observadas son consecuencia de la evolución de aquellas que aparecieron en la infancia.
Espina dorsal
La estenosis espinal lumbar inferior y déficits neurológicos concomitantes, como parestesias de los miembros inferiores, claudicación, clonus y disfunción vesical o intestinal, se vuelven más comunes en la edad adulta (Krakow D y Rimoin D, 2010).
Huesos largos
La estatura media en la edad adulta es de 131 ± 5,6 cm (hombres) y 124 ± 5,9 cm (mujeres) (Orphanet, 2017). Artritis como consecuencia del desalineamiento de miembros inferiores
Otros tejidos. Corazón
Se desconoce si las manifestaciones descritas son debidas al efecto de la mutación en las células del músculo cardiaco y del sistema vascular.
Hay una mayor prevalencia de enfermedades cardiovasculares en la acondroplasia en comparación con la población general. Se ha informado de una mortalidad superior en adultos con acondroplasia, mortalidad que se multiplica por diez en casos relacionados con enfermedades del corazón entre edades de 25 y 35 años. La esperanza de vida total parece ser de unos diez años menor en comparación con la población general (Pauli R, 2012).
Otros tejidos. Órganos reproductores
Se desconoce si las manifestaciones descritas son debidas al efecto de la mutación en las células de los órganos reproductores.
En cuanto a la fertilidad de las mujeres, hay ciertos problemas ginecológicos asociados a la acondroplasia, como infertilidad, menorragia, dismenorrea, masas uterinas benignas y menopausia precoz. Se han descrito problemas asociados con el embarazo y el parto, como preeclampsia, polihidramnios, riesgo respiratorio, prematurez y pérdida del feto.
Como consecuencia de la pelvis pequeña y contraída se requiere intervención por cesárea de sección inferior.
La anestesia general se prefiere a la anestesia regional debido a las anomalías espinales. Una mujer embarazada con acondroplasia se considera paciente de alto riesgo en términos de anestesia y resultado obstétrico, por lo que es importante ofrecer asesoramiento y diagnóstico prenatal (Ghumman S et al., 2005) (Orphanet, 2017).
BIBLIOGRAFÍA
Alman B. The role of hedgehog signalling in skeletal health and disease, Nat. Rev. Rheumatol. 2015: 11 (9): 552-60. Review.
Baujat et al 2008
Bonafe L. Et al. Nosology and classification of genetic skeletal disorders: 2015 revision. Am J Med Genet A 2015:167 A (12): 2869-92.
Bouali H, Latrech H. Achondroplasia: Current Opinions and Future Perspective. Pediatr Endocrinol Rev 2015: 12 (4): 388395.
del Pino M, Fano V Lejarraga H. Growth references for height, weight, and head circumference for Argentine children with achondroplasia. Eur J Pediatr 2011;170:453-459.
Dorsher P, McIntosh P. 2012. Neurogenic Bladder. Adv in Urology ;2012:816274.
Ghumman S, Goel N, Rajaram S, Singh KC, Kansal B, Dewan P. Pregnancy in an achondroplastic dwarf: a case report. J Indian Med Assoc. 2005; 103 (10): 536-538.
Haga N. Management of disabilities associated with achondroplasia. J Orthop Sci 2004; 9: 103-107.
Harris H. Advances in Human genetics, Springer Science & Business Media 2012.
Hecht JT, Hood OJ, Schwartz RJ, Hennessey JC, Benhardt BD, Horton WA. Obesity in achondroplasia. Am J Med Genet 1988; 31 (3): 597-602.
Histology Laboratory Manual, Bone Development: Endochondral Ossification, Columbia CNMTL, 2017.
Horton WA, Hall JG, Hecht JT. Achondroplasia. Lancet. 2007; 370 (9582): 162-72.
Hoover-Fong J, Schulze K, McGready J, Barnes H, Scott C. Age-appropriate body mass index in children with achondroplasia: interpretation in relation to indexes of height. Am J Clin Nutr 2008; 88 (2): 364-371.
Hunter AG, Bankier A, Rogers JG, Sillence D, Scott CI Jr. Medical complications of achondroplasia: a multicentre patient review. J Med Genet. 1998; 35 (9): 705-712.
Ireland P, Pacey V, Zankl A, Edwards P, Johnston M, Savarirayan R. Optimal management of complications associated with achondroplasia. Appl Clin Genet. 2014; 7: 117-125.
Narayana J, Horton WA. Molecular Genetics of Achondroplasia. eLS, 2013
Krakow D, Rimoin L. The skeletal dysplasias. Genet Med. 2012; 12, 327-341.
Mackie E et al., Endochondral ossification: How cartilage is converted into bone in the developing skeleton, Int J Biochem Cell Biol, 2008; 40(1): 46-62.
Misra S, Morgan H. Thoracolumbar spinal deformity in achondroplasia. Neurosurg Focus 2003; 14 (1): 4.
Ortega A, Hernández J, Fuentes Luis A. La acondroplasia, algo más que una cuestión de altura. AFAPA 2008.
Orphanet 2017, http://www.orpha.net/consor/cgi-bin/OC_Exp.php?Lng=GB&Expert=15
Ottonello G , Villa G, Moscatelli A , Diana M , Pavanello M. Noninvasive Ventilation in a Child Affected by Achondroplasia Respiratory Difficulty Syndrome. Paediatr Anesth 2007; 17: 75-79.
Pauli RM. Achondroplasia. Updated 2012. In: Pagon RA, Adam MP, Ardinger HH, et al., editors. GeneReviews® University of Washington, Seattle; 1993-2017.
Rodrigues C, Isaza C, Pachajoa H. Achondroplasia among ancient populations of mesoamerica and South America: Iconographic and Archaeological Evidence. Colomb Med (Cali) 2012; 43(3):212-215..
Al-Saleem A, Al-Jobair A. Achondroplasia: Craniofacial manifestations and considerations in dental management. Saudi Dent J. 2010; 22 (4): 195-199.
Shirley ED, Ain MC. Achondroplasia: manifestations and treatment. J Am Acad Orthop Surg. 2009; 17 (4): 231-41.
Unger S, Bonafé L, Gouze E. Current Care and Investigational Therapies in Achondroplasia. Curr Osteoporos Rep. 2017; 15 (2): 53-60.
Wright M, Irving M. Clinical management of achondroplasia. Arch Dis Child, 2012; 97 (2): 129-134.
Zaffanello M, Cantalupo G, Piacentini G, Gasperi E, Nosetti L, Cavarzere, Ramaroli D, Mittal A, Antoniazzi F. Sleep disordered breathing in children with achondroplasia. World J Pediatr. 2017; 13: 8-14.
Zahl S, Egge A, Helseth E, Wester K. Benign external hydrocephalus: a review, with emphasis on management. Neurosurg Rev. 2011; 34 (4): 417-432.

La Fundación ALPE Acondroplasia fue creada el 24 de enero de 2000 gracias al entusiasmo de varias personas, Carmen Alonso, Miguel López y la familia Press-Lewis, fundamentalmente. La familia Press-Lewis había fundado ProChon Biotech Ltd. en Tel-Aviv (Israel) para la búsqueda de una terapia para la acondroplasia. ProChon fue germen de avances científicos en la investigación de la acondroplasia que dan frutos cada vez más interesantes.
ENLACES
CONSULTAS MÉDICAS
Fundación ALPE Acondroplasia
Calle Conde Real Agrado, 2
33205 Gijón







